本世纪初即已发现,在不同种属或同种不同系的动物个体间进行正常组织或肿瘤移植会出现排斥,它是供者与受者组织不相容的反映。其后证明,排斥反应本质上是一种免疫反应,它是由组织表面的同种异型抗原诱导的。这种代表个体特异性的同种抗原称为组织兼容性抗原(histocompatibility antigen)或移植抗原(transplantation antigen)。机体内与排斥反应有关的抗原系统多达20种以上,其中能引起强而迅速排斥反应者称为主要组织兼容性抗原,其编码基因是一组紧密连锁的基因群,称为主要组织兼容性复合体(major histocompatibilitycomplex,MHC)。现已证明,控制机体免疫应答能力与调节功能的基因(immune uesponse gene,Ir gene)也存在于MHC内。因此,MHC不仅与移植排斥反应有关,也广泛参与免疫应答的诱导与调节。不同种属的哺乳类动物其MHC及编码的抗原系统有不同的命名,小鼠的主要组织相容性抗原系统称为H-2系统,人的则称为人白细胞抗原系统(human leucocyte antigen,HLA)。但它们的组成结构、分布和功能等却很相似。小鼠由于具有繁殖快、易于饲养等特点成为进行MHC研究的最重要动物。迄今对人类MHC的认识在很大程度上也来自对小鼠MHC即H-2复合体的研究。
第一节MHC基因结构
一、小鼠H-2基因复合体
(一)H-2复合体的结构
本世纪30年代,Gorer在鉴定近交系小鼠血型抗原时曾发现4组红细胞抗原,命名为抗原Ⅰ、Ⅱ、Ⅲ和Ⅳ。其中抗原Ⅱ只存在于某些品系而不存在于另一些品系小鼠中。其后,Snell等用近交系小鼠中生长的肿瘤分别移植于其杂交子代,肿瘤只能在抗原Ⅱ阳性小鼠体内生长,在抗原Ⅱ阴性小鼠体内则被排斥,证明了抗原Ⅱ是一种组织兼容性抗原,故称小鼠的组织兼容性抗原为H-2(histocompatibility antigen-2,H-2)。以后,相继证明编码H-2抗原的基因定位于小鼠第17对染色体上,并证明是由多基因座组成,故称此基因群为主要组织相容性基因复合体。
这是一组紧密连锁的基因群,位于第17对染色体上的一个狭窄的区段内,它是由4个遗传区域(uegion)组成,即K区、I区、S区和D区。其中I区又可分为二个亚区(subrugion)即I-A和I-B亚区。在每区或亚区内至少包括一个基因座,如K区基因称为H-2K座。D区至少含有二个座,即H-2D座和H-2L座。I-A亚区含有Aα和Bβ二个座,I-E亚区含E-α和E-β二个座,S区含有6个座。
K和D区基因可编码H-2抗原系,I区基因编码的分子称为I区相关抗原或Ia抗原系(I-region associated antigen,Ia)。S区基因可分别编码补体成分(C4和B因子等)、性限制蛋白(sex-Iimited protem,SIP)以及TNF等因子(图5-1)
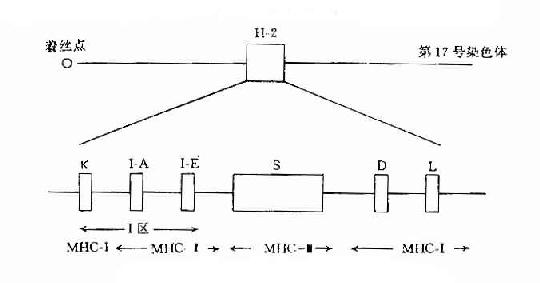
图5-1小鼠H-2复合体结构示意图
(二)H-2复合体的功能
Kiein于1981年按其功能将MHC基因座分为4类,即Ⅰ类座包括K、D和L座,其编码的分子称为Ⅰ类分子,即K、D和L分子。Ⅱ类座其编码的分子称为Ⅱ类分子即Ia抗原。Ⅲ类座其编码的分子称为Ⅲ类分子(包括血清因子、补体分子及TNF等)。Ⅳ类座位于D座右侧,是否属于H-2复合体尚未确定,但与H-2连锁,它包括Tla座和Qa座,其编码的分子称为Ⅳ类分子(Tla分子和Qa分子)。
1.Ⅰ类基因(H-2K,H-2D基因)Snell于50年代偶然发现H-2基因座不是由一个基因组成,他观察到二个品系小鼠(k/k和d/d)杂交的子代(F1:k/d)鼠能接受第三个品系小鼠,(a/a)的肿瘤移植,他对这种意外结果解释为H-2基因座含有二个基因(K/D),a/a品系小鼠具有来自k/k小鼠的一个基因(K)和来自d/d小鼠的另一个基因(D)。这种组合衍生自二个染色体上的相应位置分别称为K座(K locus)和D座(DLocus),二个座分别编码不同的H-2抗原(K分子和T分子)即Ⅰ类分子。
在不同的品系中,K和D分子可能具有不同的抗原特异性称之为特有抗原(prviate antigen)。在K和D分子之间也存在一引些共同的抗原特异性称之为共有抗原(public antigen)。不同的抗原特异性可用编码抗原基因座名称和按检出顺序标明之,如K33、D2等。
在一条染色体上K和D座存在的基因总合称为H-2的单体型(haplotype),不同的单体型可用小写字母表示之。如C57BL品系小鼠的H-2单体型为H-2b,它的二个基因座编码的抗原特异性为K33和D2。
2.Ⅱ类基因(免疫应答基因)近年来对免疫应答的遗传控制进行了系统研究,证明运动对许多抗原的免疫应答是受常染色体显性基因控制,称此基因为免疫应答基因(immune response gene,Ir基因)。McDevitt等研究了小鼠对人工合成多肽体抗原的免疫应答,首先证明了Ir基因与H-2复合体呈连锁关系,定位于H-2K和H-2D座之间,因与免疫应答相关,故称此区段为I区。
通过不同品系小鼠之间交配获得一种具有相同K和D基因的特殊重组体。有这种重组体小鼠进行相互免疫,惊奇地发现在K和D基因之间的染色体区段也控制细胞膜表面的同种异型抗原,将这种新发现的同种异型抗原称为I区相关抗原,即Ia抗原。这种抗原与K和D分子不同,它主要存在于B细胞、巨噬细胞、树突状细胞以及活化的T细胞上,而在其它组织上均未能发现Ia抗原的存在。其后证明Ia分子与多肽抗原呈递相关。
3.Ⅲ类类基(系指H-2S区的基因)此区含有6个座,包括C4、C2、Bf、Slp、TNF等基因。分别编码C4分子、C2分子、补体B因子,性限制蛋白及肿瘤坏死因子(TNF)等。
二、人类HLA基因复合体
对人主要组织兼容性抗原系统及其基因复合体的认识比小鼠约晚10年,法国学者Dausset在1958年首先发现,肾移植后出现排斥反应的患者以及多次输血的患者血清中含有能与供者白细胞发生反应的抗体。后者所针对的抗原即人类主要组织相溶性抗原。由于该抗原首先在白细胞表面被发现且含量最高,而且白细胞抗原(human leucocyte antigen,HAL);人类MHC,即编码HLA的基因群自然数为HAL复合体。
(一)HLA复合体定位及结构
HLA复合体位于人第6号染色体的短臂上。该区DNA片段长度约3.5~4.0×千个碱基对,占人体整个基因组的1/3000。图5-2显示HLA复合体结构。HLA复合体共有数十个座,传统上按其产物的结构、表达方式、组织分布与功能可将这些基因座分为三类。

图5-2人类HLA复合体结构示意图
1.HLA-Ⅰ类基因在Ⅰ基因区内存在多达31个有关的Ⅰ类基因座,其中HLA-A、HLA-B和HLA-C为经典的HLA-Ⅰ类基因,其它基因的产物分布有限,且其功能不明,另外还有许多伪基因.
2.HLA-Ⅱ类基因HLA-Ⅱ类基因区包括近30个基因座,其中经典的Ⅱ类基因一般指DR、DP和DQ,它们编码的产物均为双肽链(α、β)分子。近年来,陆续发现了一些位于Ⅱ类基因区的新基因座,其中某些基因的产物与内源性抗原的处理与呈递有关。
3.HLA-Ⅲ类基因HLA-Ⅲ类基因区域至少已发现36个基因座,其中C2、C4、Bf座编码相应的补体成分,另外还有21羧化酶基因(CYP21A、B)肿瘤坏死因子基因(TNFA、B)以及热休克蛋白70(heat shock protein70,HSP70)基因。补体C4由二个不同的基因(C4A与C4B)编码。HLA-Ⅲ类基因区结构见图5-3。
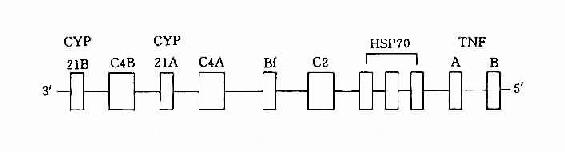
图5-3 HLA-Ⅲ基因区结构示意图
(二)HLA等位基因及编码产物的命名
按WHO-HLA命名委员会发布的资料,仅经典的HLA-Ⅰ、Ⅱ类座(A、B、C、DR、DQ、DP)等位基因即达279个。表5-1列出了至1991年11月已识别的HLA特异性。根据该委员会制定的命名原则,凡确定新的HLA抗原特异性都要明确其DNA序列。此外,下列几种情况在HLA特异性编号后加W(workshop)标记。
表5-1已识别的HLA特异性(1991)
A |
B |
C |
D |
DR |
DQ |
DF |
A1 |
B5 B51(5) |
Cw1 |
Dw1 |
DR1 |
DQ1 |
DPw1 |
A2 |
B7 B5102 |
Cw2 |
Dw2 |
DR103 |
DQ2 |
DPw2 |
A210(2) |
B703 B5103(7) |
Cw3 |
Dw3 |
DR2 |
DQ3 |
DPw3 |
A3 |
B8 B52(5) |
Cw4 |
Dw4 |
DR3 |
DQ4 |
DPw4 |
A9 |
B12 B53 |
Cw5 |
Dw5 |
DR4 |
DQ5(1) |
DPw6 |
A10 |
B13 B54(22) |
Cw6 |
Dw6 |
DR5 |
DQ6(1) |
|
A11 |
B14 B55(22) |
Cw7 |
Dw7 |
DR6 |
DQ7 |
|
A19 |
B15 B54(22) |
Cw8 |
Dw8 |
DR7 |
DQ18(3) |
|
A23(9) |
B16 B57(17) |
Cw9(w3) |
Dw10 |
DR8 |
DQ19(3) |
|
A24(9) |
B17 B54(17) |
Cw1(w3) |
Dw11(w7) |
DR9 |
|
|
A2403(9) |
B18 B59 |
|
Dw12 |
DR10 |
|
|
A25(10) |
B21 B60(40) |
|
Dw13 |
DR11(5) |
|
|
A26(10) |
B22 B61(40) |
|
Dw14 |
DR12(5) |
|
|
A28 |
B27 B62(15) |
|
Dw15 |
DR13(5) |
|
|
A29(19) |
B35 B63(15) |
|
Dw16 |
DR13(6) |
|
|
A30(19) |
B37B64k(14) |
|
Dw17(w7) |
DR14(6) |
|
|
A31(19) |
B38(16 B65(14) |
|
Dw18(w6) |
DR1403 |
|
|
A32(19) |
B39(16)B67 |
|
Dw19(w6) |
DR1404 |
|
|
A33(19) |
B40 B70 |
|
Dw20 |
DR15(2) |
|
|
A34(10) |
B4005(21) B71(70) |
|
Dw21 |
DR16(2) |
|
|
A36 |
B41 B72(70) |
|
Dw22 |
DR17(3) |
|
|
A43 |
B42 B73 |
|
Dw23 |
DR18(3) |
|
|
A66(10) |
B44(12) B75(15) |
|
|
DR51 |
|
|
A68(28) |
B45(12) B76(15) |
|
Dw24 |
|
|
|
A69(28) |
B46 B77(15) |
|
Dw25 |
DR52 |
|
|
A74(19) |
B47 B7801 |
|
B-26 |
DR53 |
|
|
B48 |
B49(21)Bw4 |
B50(21)Bw6 |
①Bw4和Bw6作为表位以其它B座等位基因个区别;②C座的特异性加w,以与补体相区分;③由经典细胞学分型方法鉴定D和DP特异性加W。
(三)HLA复合机遗传特征
HLA复合体具备某些有别于其它真核基因系统的特征。
1.单体型遗传方式HLA复合体是一组紧密连锁的基因群。这些连锁在一条染色体上的等位基因很少发生同源染色体间的交换,构成一个单体型(haplotype)。在遗传过程中,HLA单体型作为一个完整的遗传单位由亲代传给子代。有必要区分HLA表型、基因型与单体型这三个概念。某一个体HLA抗原特异性型别称为表型(phenotype);HLA基因在体细胞两条染色体上的组合称为基因型(genotype);HLA基因在同一条染色体上的组合称为单体型(haplotype)(表5-2)。
受检者 |
甲 A1 A2 B8 B12 |
乙 A1 A1 B8 B12 |
丙 A1 A1 B8 B8 |
表型 |
HLA-A1、2:B8、12 |
HLA-A1:B8、12 |
HLA-A1、B8 |
基因型 |
HLA-A1、A2 HLA-B8、B12 |
HLA-A1、A1 HLA-B8、B12 |
HLA-A1、A1 HLA-B8、B8 |
单体型 |
HLA-A1、B8/A2、B12 |
HLA-A1、B8/A1、B12 |
HLA-A1、B8/A1、B8 |
二倍体(diploid)生物的每一细胞均有两个同源染色体组,分别来自父母双方。故子女的HLA单体型也是一个来自父方,一个来自母方。在同胞之间比较HLA单体型型别只会出现下列三种可能性:二个单体型完全相同或完全不同的机率各占25%;有一个单体型相同的机率占50%。至于亲代与子代之间则必然有一个单体型相同,也只能有一个单体型相同(图5-40。这一遗传特点在器官移植供者的选择以及法医的亲子鉴定中得到了应用。
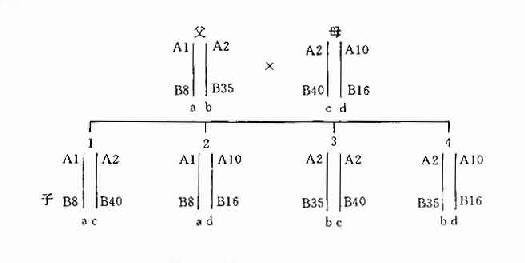
图5-4HLA单体型遗传示意图
注:a、b、c、d代表单体型
A1、B8、A2、B35等代表HLA基因座等位基因
2.多态性现象 多态性(polymorphism)是指在一随机婚配的群体中,染色体同一基因座有两种以上基因型,即可能编码二种以上的产物。HLA复合体是迄今已知人体最复杂的基因复合体,有高度的多态性。HLA的多态性现象乃由于下列原因所致:①复等位基因(multiple alleles):位于一对同源染色体上对应位置的一对基因称为等位基因(allele);由于群体中的突变,同一座的基因系列称为复等位基因。前已述及,HLA复合体的每一座均存在为数众多的复等位基因,这是HLA高度多态性的最主要原因。由于各个座位基因是随机组合的,故人群中的基因型可达108之多。②共显性(codominance);一对等位基因同为显性称为共显性。HLA复合体中每一个等位基因均为共显性,从而大大增加了人群中HLA表型的多样性,达到107数量级。因此,除了同卵双生外,无关个体间HLA型别全相同的可能性极小。
HLA的高度多态性显示了遗传背景的多样性,这可能是高等动物抵御不利环境因素的一种适应性表现,从而维持种属的生存与延续具有重要的生物意义,但也对组织移植过程中寻找配型合的供体带来很大的困难。
3.连锁不平衡HLA复合体各等位基因均有其各自的基因频率。基因频率是指某一特定等位基因与该基因座中全部等位基因总和的比例。随机婚配的群体中,在无新的突变和自然选择的情况下,基因频率可以代代维持不变,由于HLA复合体和各基因座是紧密连锁的,若各座的等位基因随机组合构成单体型,则某一单体型型别的出现频率应等于该单体型各基因比其它基因能更多或更少地连锁在起,从而出现连锁不平衡(linkage disepuilibrium)。例如,在北欧白人中HLA-A1和HLA-B8频率分别为0.17和0.11。若随机组合,则单体型A1-B8的预期频率为0.17×0.11=0.019。但实际所测行的A1-B8单体型频率是0.088故A1-B8处于连锁不平衡,实测频率与预期频率间的差值(△0.088-0.19=0.069)为连锁不平衡参数。在HLA复合体中已发现有50对以上等位基因显示连锁不平衡。产生连锁不平衡的机制尚不清楚。
第二节MHC抗原
一、HLA抗原的分子结构
1987年Bjorkman等首先借助X线晶体衍射技术弄清了HLA-A2分子的立体结构。其后,其它HLA-Ⅰ、Ⅱ类分子结构的研究也取得了进展,从而对这些分子的生物学功能提供了较确切的解释。
(一)HLA-Ⅰ类分子
所有的HLA-Ⅰ类分子均含有二条分离的多肽链,一条是由MHC基因编码的α链或称重链(44kD)。根据对HLA-A2和Aw68分子的晶体结构分析,Ⅰ类分子可分为四个区:(图5-5):①氨基端胞外多肽结合区:该区由二个相似的各包括90个氨基酸残基的片段组成,分别称为α1和α2。该功能区含有与抗原结合的部位。后者呈深槽状,其大小与形状适合于已处理的抗原片段,约容纳8~10个氨基酸残基。Ⅰ类分子的多态性残基也位于该区域。②胞外lg样区:该区又称为重链的α3片段,包括90个氨基酸残基,与免疫球蛋白的恒定区具有同源性。Ⅰ类分子与TC细胞表面CD8分子的结合部位即在α3片段。Ⅰ类分子的β链又称β2微球蛋白,也结合于该区。β链由第15号染色体的基因编码,它不插入细胞膜而游离于细胞外。β2微球蛋白与α1、α2、α3片段的相互作用对维持Ⅰ类分子于然构型的稳定性及其分子表达有重要意义。③跨膜区:该区氨基酸残基形成螺旋状穿过浆膜的脂质双层,将类分子锚定在膜上。④胞浆区:该区位于胞浆中,可能与细胞内外信息传递有关。
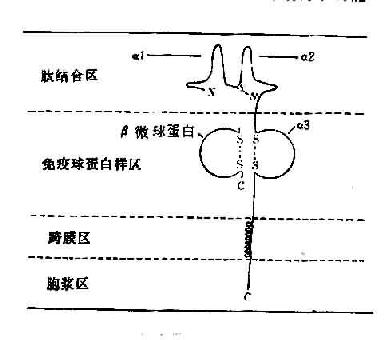
图5-5HLA-Ⅰ类分子结构示意图
(二)HLA-Ⅱ类分子
所有的Ⅱ类分子均由二条以非共价键连接的多肽链(α、β)组成。二条链的基本结构相似,但分别由不同的MHC基因编码,且均具有多态性。虽然Ⅱ类分子的晶体衍射结构尚未得到,但光谱分析已证明与Ⅰ类分子具有某种相似性。Ⅱ类分子二条多肽链也可分为四个区,见(图10-6):①肽结合区:α链与β链的胞外部位均可再分为二个各含90个氨基酸残基的片段,分别称为α1、α2和β1、β2。肽结合区包括α1和β1片段,该二片段构成肽结合的裂隙(cleft),约可容纳14个氨基酸残基。Ⅱ类分子的多态性残基主要集中在α1和β1片段,这种多态性决定了多肽结合部位的生化结构,也决定了与肽类结合以及T细胞识别的特异性和亲和力。②lg样区:此区由α2和β2片段组成,两者均含链内二硫键,并属于lg基因超家族。在抗原呈递过程中,TH细胞的CD4分子与Ⅱ类分子结合的部位即位于该lg样非多肽态区域。③跨膜区和胞浆区:该二区与Ⅰ类分子α链的相应区域结构相似。
二、HLA抗原的组织分布
各类HLA抗原的组织分布不同。Ⅰ类抗原广泛分布于体内各种有核细胞表面,包括血小板和网织红细胞。除某些特殊血型者外,成熟的红细胞一般不表达Ⅰ类抗原。不同的组织细胞表达Ⅰ类抗原的密度各异。外周血白细胞和淋巴结、脾细胞所含Ⅰ类抗原量最多,其次为肝、皮肤、主动脉和肌肉。但神经细胞和成熟的滋养层细胞不表达Ⅰ类抗原。Ⅱ类抗原主要表达在某些免疫细胞表面,如B细胞、单核/巨噬细胞,树突状细胞,激活的t细胞等,内皮细胞和某些组织的上皮细胞也可检出HLA-Ⅱ抗原。另外,某些组织细胞在病理情况下也可异常表达Ⅱ类抗原。Ⅰ、Ⅱ类抗原主要分布在细胞表面,但也可能现于体液中,血清、尿液、唾液、精液及乳汁中均已检出可溶性HLA-Ⅰ、Ⅱ类抗原。HLA-Ⅲ类抗原一般指几种补体成分,它们均分布于血清中。
三、HLA抗原表达的调控
在各类型细胞表面HLA分子表达与否以及表达的密度,可以受不同的因素调节。一般认为,调控HLA分子表达的主要环节是转录速率。可能影响HLA分子表达的因素有:①组织细胞的分化阶段:HLA分子是造血干细胞和某些免疫细胞的分化抗原,在细胞分化、成熟的不同阶段,各类HLA抗原的表达可有改变。例如HLA-DQ分子是人单核细胞的成熟标记;Ⅱ类抗原仅表达在激活的T细胞表面。②某些疾病状态:某些传染性疾病、免疫性疾病、造血系统疾病以及肿瘤均可影响HLA抗原表达。如AIDS病患者单核细胞HLA-Ⅱ类抗原表达明显减少,某些肿瘤细胞表面HLA-Ⅰ类抗原表达减少。③生物活性物质:某些细胞因子,例如三类干扰素(α、β、γ)以及TNFα、THFβ均可增强不同类型细胞HLA-Ⅰ类抗原表达;具有Ⅱ类抗原诱生能力的细胞因子包括IFNγ、TNFα、IL-6及GM-CSF等。此外,某些激素、某些神经递质和神经肽也可影响HLA分子表达。
HLA分子在免疫应答与免疫调节中是一类关键的分子,故各种因素对HLA分子表达的调控可能是体内免疫调节网络的重要组成部分。同时,受各种调节因子的影响,HLA分子的异常表达也参与某些疾病的发病机制。
第三节MHC分子的功能
MHC最初是在研究排斥反应的过程中发现的。MHC分子作为代表个体特异性的主要组织抗原,在排斥反应中起重要作用。自从60年代发现了Ir基因,70年代发现了细胞毒性T细胞与靶细胞间相互作用的MHC限制性后,对MHC的生物学作用有了更深入的认识。MHC的主要功能包括:
一、参与对抗原处理
MHC分子在多个环节参与对抗原处理。外源性抗原在APC内被降解成免疫原性多肽,并与MHC-Ⅱ类分子结合成稳定的复合物,从而保证了多肽不被进一步降解为氨基酸。80年代末还发现,内源性抗原在靶细胞中须与胞浆中的一种蛋白酶体(proteasome)结合才能进一步分解为免疫原性多肽片段,后者再在一种肽链转运蛋白的参与下被转运到内质网腔与新合成的MHC-Ⅰ分子结合。已证明蛋白酶体相关基因及肽链转运基因均位于MHC-Ⅱ类基因区内。
二、约束免疫细胞间相互作用
70年代中期Zinkernagel等发现,细胞毒性T细胞只杀伤具有同一MHC表型的病毒感染的靶细胞。这意味着T细胞识别细胞表面抗原决定簇的同时,还须识别细胞上的MHC分子。以后证实,不仅TC靶细胞间,而且Mφ-TH,TH-B以及TH-TC间的相互作用也受MHC约束。这一现象,即具有同一MHC表型的免疫细胞才能有效地相互作用,称为MHC限制性(MHCrestriction)。
巨噬细胞(Mφ)与TH细胞间的相互作用受MHC-Ⅱ类抗原的约束。TH的TCR联合识别免疫原性多肽片段的表位(epitope)以及MHC-Ⅱ分子α1、β1功能区的多态性决定簇。同时,TH细胞表面的CD4分子识别MHC-Ⅱ类分子α2、β2功能区的非多肽性决定簇,由此启动免疫应答。因此,只有MHC-Ⅱ类分子阳性细胞才具有抗原呈递能力,且细胞表面Ⅱ类分子密度与其抗原呈递能力呈正相关。
TC与病毒感染的靶细胞相互作用受MHC-Ⅰ类抗原的约束。TC的TCR联合识别靶细胞表面的病毒抗原以及MHC-Ⅰ类分子α2和β2功能区的多态性决定簇。同时,TC表面的CD8分子识别Ⅰ类分子α3区的非多态性决定簇。
三、参与对免疫应答的遗传控制
机体对某种抗原物质是否产生应答以及应答的强弱是受遗传控制的。控制免疫应答的基因称为Ir基因。小鼠Ir基因位于H-2Ⅰ区内。人的Ir基因定位目前尚无直接证据,但一般认为也位于HLA-Ⅱ类等位基因的个体,其对特定抗原的免疫应答能力各异。
四、诱导自身或同种淋巴细胞反应
MHC分子可作为自身或同种反应的刺激分子从而诱导免疫应答或参与免疫调节。
1.参与免疫调节非T细胞(Mφ、B细胞等)在体外能诱导自身T细胞发生增殖反应,此即自身混合淋巴细胞反应(autologous mixed Iymphocytereaction,AMLR)。在AMLR中非T细胞表面的刺激决定簇是HLA-DQ(小鼠H-2I-A)分子。自身反应性T细胞增殖后可表达HLA-DR(小鼠H-A I-E)抗原,后者又作为刺激分子激活某些T细胞,此T-T AMLR。AMLR代表体内免疫细胞间的一种调节机制,有助于维持免疫自稳,故MHC-Ⅱ类分子通过诱发AMLR而参与免疫调节。
2.诱导免疫反应MHC分子是一种同种异型抗原,可诱导同种反应的发生,典型的例子是体外的同种异型混合淋巴细胞反应和体内同种移植排斥反应。在这两种情况下,反应性T细胞对非已MHC抗原的识别不受自身MHC限制。
五、参与T细胞分化过程
早期T细胞在胸腺中发育为成熟T细胞的过程中,伴随着一系列表面标志的变化。MHC分子对T细胞的分化发育起着重要作用,早期T细胞必须与表达MHC-Ⅰ或Ⅱ类抗原的胸腺上皮细胞接触才能分别分化成CD8+或CD4+T细胞。
第四节HLA的医学意义
HLA领域的研究工作在医学实践中有十分重要的意义。
一、HLA与疾病相关性
不同个体对疾病易感性的差异在很大程度上是由遗传因素所决定。在群体调查中比较患者与正常人某些特定等位基因及其产物的频率,这是研究遗传决定的对疾病易感性的主要方法。
HLA是目前已知的具有最复杂多态性的人类基因系统,且Ir基因正位于HLA复合体内,因此考虑到HLA与某些免疫性疾病可能存在相关性。60年代末通过对患者与正常人HLA抗原频率的群体调查,发现了某些疾病与特定的HLA型分别呈非随机分布。最典型的例子是91%以上的北美白人强直性脊柱炎患者带有HLA-B27抗原。这种现象,即二个遗传学性状在群体中同时出现呈非随机分布,称为关联(association)。HLA是第一个被发现与疾病有明确联系的遗传系统。迄今已发现60余种疾病与HLA有关联,这些多属于病因或发病机制未知、与免疫异常有关,或有家族倾向及环境诱发因素的疾病。特定疾病与某种HLA型别的相关性可通过相对危险性(relative risk,RR)来评估,其计算公式为:
RR=P+×C―/P―×C+
式中P+为具有某种抗原的病人数;C―为不带此抗原的对照组人数;P―为不带此抗原的病人数;C+为具有此抗原的对照组人数。RR表示带某种HLA抗原的人与无此种抗原的人在患某种疾病的危险性上的比值。RR=1时,两者无关联;若RR>4,则认为此病与某种HLA抗原肯定有关联;RR值越大,表示带此抗原的人患某病的危险性越大。反之,若RR<1,表示带此抗原者某病有抵抗性。
在评估HLA与疾病的相关性时须注意下面几点:①发现HLA与某种疾病有关联,并不意味着携带某抗原就一定会患某病,HLA本身并不是病因而仅仅是一种遗传标志;②HLA抗原在群体中的分布与民族、人种、地理环境等有关,在研究与疾病的关联时应综合分析才有参考价值;③研究对象须是随机选择,无亲缘关系的:对照组与疾病相关性可能有助于某些疾病的辅助诊断,疾病的预测、分类以及预后的判断。表5-3列出某些疾病与HLA的相关性。
表5-3 HLA和疾病的相关性
疾病 |
HLA抗原 |
相对危险性RR |
强直性脊柱炎 |
Ⅰ类型B27 |
>100 |
青少年类风湿性关节炎 |
B27 |
24 |
Reiter病 |
B27 |
30~50 |
牛皮癣性关节炎 |
B17 |
6 |
Bechat综合征 |
Cw6 |
9 |
发作性睡眠 |
B51 |
10~15 |
寻常天疱疮 |
Ⅱ类DR2 |
20 |
I型糖尿病 |
DR4 |
24 |
多发性硬化症 |
DR3/DR4 |
20 |
全身性红斑狼疮 |
DR2 |
4 |
全身性硬化症 |
Ⅲ类C4AQO C4BQO C4AQO |
6 11 9 |
迄今已检出了众多的HLA基因多态性标志。因此,有可能在DNA水平上探讨HLA与疾病的相关性,甚至发现一些与经典HLA抗原未表现出关联,但与HLA基因型别关联的疾病。可以预期,随着DNA水平的研究不断深入,最终有可能在HLA复合体中发现某些疾病的易感基因,甚至测出这些基因的核苷酸序列。这将有助于阐明某些疾病的发病机制,并在此基础上制订全新的防治措施。
HLA与疾病关联的机制尚未完全清楚,已提出的一些学说包括:①分子模拟学说:该学说认为,由于HLA抗原本身与某种病原物质相似,机体或者不能对该病原物质产生有效的免疫应答,或者在对病原物的应答中发生交叉反应反而损害了自身组织;②受体学说:HLA抗原可能作为外来病原物质的受体,两者结合导致组织损伤;③免疫应答基因学说:人的HLA基因就是Ir基因,特定的Ⅱ类基因型可能导致特定的异常免疫应答,从而表现为易感某种疾病;④连锁不平衡学说:特定的HLA基因可能与某病的易感基因连锁,HLA型别仅是一种检出的遗传标志。一般认为,与HLA有关联的不同病种可能有不同的机制。
二、HLA表达异常与疾病的关系
HLA表达异常即细胞表面HLA分子质与量的异常,可参与疾病发生。
(一)HLA-Ⅰ类抗原表达异常
在小鼠及许多人类肿瘤或肿瘤衍生的细胞株均已发现MHC-Ⅰ类抗原表达缺失或密度降低。若将Ⅰ类基因转染给肿瘤细胞株,则恶变细胞可发生逆转,且浸润性与转移性消失或降低。这可能是由于MHC-Ⅰ类抗原缺失的肿瘤细胞不能补TC识别并攻击,从而导致肿瘤免疫逃逸(sneaking through)。
(二)HLA-Ⅱ类抗原表达异常
器官特异性自身免疫疾病的靶细胞可异常表达HLA-Ⅱ类抗原。诸如Graves病患者的甲状腺上皮细胞、原发性胆管肝硬化患者的胆管上皮细胞、Ⅰ型糖尿病患者的胰岛β细胞等均可发现HLA-Ⅱ抗原异常表达。其机制可能是局部感染诱生IFN-γ,后者诱导Ⅱ类抗原表达。Ⅱ类抗原乃抗原呈递的效应分子,一旦靶细胞异常表达Ⅱ类抗原,就可能以组织特异性方式把自身抗原呈递给自身反应性T细胞,从而启动自身免疫反应。激活的自身反应性TH又可分泌大量IFN-γ,诱导更多的靶细胞表达Ⅱ类抗原,加重和延续自身免疫反应,最终导致迁延不愈的自身组织损伤。
三、HLA与排斥反应
移植物存活率很大程度上取决于供者和受者之间HLA型别相合的程度。在肾移植中,各HLA座配合的重要性依次为HLA-DR、HLA-B、HLA-A。近年来特别重视HLA-DP对移植器官长期存活的意义。在骨髓移植中,为预防严重的移植物抗宿主反应(graft versus host reaction,GVHR),一般要求从同胞中选择HLA全相同的个体作为供者。此外,某些输血反应以及习惯性流产也与HLA不兼容所导致的排斥反应有关。
四、HLA与法医
由于HLA复合体的高度多态性,在无关个体间HLA表型全相同的机率极低,故HLA复合体被看作是伴随个体终生的特异性遗传标记。借助HLA基因型和(或)表型检测,可用于法医上的个体识别。另外,由于HLA复合体具有高度多态性以及单倍型遗传的特点,使HLA分型成为鉴定亲子关系的重要手段。
第五节HLA分型技术
HLA分型并不只是一种应用性的临床检测指标,免疫遗传学研究的发展,很大程度上依赖于以分型为主要手段的HLA多态性分析。60年代建立的并不断完善的血清学及细胞学分型技术主要侧重于分析HLA产物特异性;80年代起建立的DNA分型方法则侧重于基因的分型。
一、血清学分型技术
(一)HLA-Ⅰ类抗原的检测
HLA-A、B、C抗原型别鉴定均借助微量淋巴细胞毒试验(microlymphocytotoxicitytest)或称补体依赖的细胞毒试验(complement dependent cytotoxicitytest)。原理为取已知HLA抗血清加入待测外周血淋巴细胞,作用后加入免补体,充分作用后加入染料,在倒置显微镜下判断结果,着染的细胞为死亡细胞,表示待检淋巴细胞表面具有已知抗血清所针对的抗原。标准抗原清取自多次经产妇或计划免疫志愿者。
(二)HLA-DR、DQ抗原检测
该二抗原分型方法同HLA-Ⅰ类抗原,但所用抗血清须经过血小板吸收以去除针对Ⅰ类抗原的抗体。另外,待测细胞须是经纯化的B细胞。
血清学分型是一项古老的技术,虽然近年来已建立许多新的分型技术,但血清学方法目前仍是HLA分型的基础。
二、细胞学分型技术
HLA-Dw特异性与HLA-DP特异性可分别通过纯合分型细胞(homozygote typing cell,HTC)及预致敏淋巴细胞试验(primed lymphocyte test,PLT)检测。二种方法的基本原理均是判断淋巴细胞在识别非已HLA抗原决定簇后发生的增殖反应。由于分型细胞来源困难以及操作手续繁琐,细胞学分型技术下正逐渐淘汰。
三、HLA的DNA分型技术
上述传统的HLA分型方法有许多不足之处,近年来国内外已将HLA分型技术由抗原水平发展到基因水平。
(一)限制性片段长度多态性检测技术
这是首先建立的对多态性进行检测的DNA分析技术。个体间抗原特异性来自氨基酸顺序的差别,后者由编码基因的碱基顺序不同所决定。这种碱基顺序的差别造成限制性内切酶识位置及酶切位点数目的不同,从而产生数量和长度不一的DNA酶切片段。用特异性探针对整个基因组DNA酶切片段进行杂交,即可分析限制性长度片段多态性(restriction fragment lengthpolymorphism,RFLP)。一定的内切酶组合所得到的HLA-RFLP可以和传统方法测定的HLA特异性型别相关。80年代末发展起来的PCR(polymerase chain reaction)技术已被用于RFLP分析,即用等位特异限制酶裂解PCR扩增的片段,然后再进行分析,从而大提高了灵敏度。
(二)PCR/SSO技术
此法乃用人工合成的HLA型别特异的寡核苷酸序列作为探针,与待检细胞经PCR扩增的HLA基因片段杂交,从而确定HLA型别,PCR技术可将HLA复合体上指定基因片段特异性地扩增5~6个数量级;而专门设计的SSO(序列特异的寡核苷酸sequencedpecific oligonucleotide)探针又能探测出等位基因间1~2个核苷酸的差异,故PCR/SSO技术具有灵敏度、特异性强、需样本量少等优点。
(三)PCR/SSP技术
目前常规的HLA-DNA分型技术,包括上述的PCR/RFLP、PCR/SSO等,最终均需用标记的特性探针与扩增产物进行杂交,再分析结果。PCR/SSP方法用乃设计出一整套等位基因组特异性引物(sequence specific primer,SSP),借助PCR技术获得HLA型别特异的扩增产物,可通过电泳直接分析带型决定HLA型别,从而大大简化了实验步骤。
由于传统方法在Ⅱ类抗原分型方面困难较大,故上述几种基因分析型方法目前主要用于Ⅱ类基因座。此外,目前已建立的HLA基因分型技术还包括PCR单链构像多态性分析(PCR-single strand conformational polymorphism,PCR-SSCP)和PCR异源二聚体电泳多态即PCR指纹图(PCr fingerprinting)分析。DNA分型技术的应用,使HLA型别分析达到了更精细的水平,并因此发现了更多的HLA多态性。HLA的DNA分型技术现已成为血清学方法的竞争者,并可能在不久的将来完全取而代之。
HLA是目前所知人体最复杂的遗传多态性系统。HLA研究涉及免疫学、生物学、遗传学、分子生物学、医学等多个学科,并已发展成为一个独立的学科分支。迄今HLA研究已达到相当深入的水平,并在诸多方面取得显著进展,包括HLA复合体结构;HLA分子结构及其表达的调控;HLA分子功能,尤其是在抗原处理、呈递及T细胞识别中的作用;HLA的DNA分型及多态性研究;HLA与疾病的关系;HLA与移植的关系等。HLA研究不仅使器官移植成为一种极有价值的治疗手段,并给基础与临床免疫带来了突破性进展。已经证实,HLA复合体中存在控制免疫应答的基因以及HLA参与约束免疫细胞间相互作用,这表示HLA涉及生命活动的各个水平与多个方面。可以预期,对HLA的研究将继续成为免疫遗传学最活跃的部分;对HLA的应用将扩展到基础、临床、预防医学的各个领域。

